Los científicos del Instituto McGovern para Brain Research en MIT y el Broad Institute of MIT y Harvard han rediseñado una enzima compacta guiada por ARN que encontraron en las bacterias en un editor apto y programable de ADN humano.
La proteína que crearon, emplazamiento NovaISCB, se puede adaptar para hacer cambios precisos en el código hereditario, modular la actividad de genes específicos o sufrir a sitio otras tareas de estampado. Adecuado a que su pequeño tamaño simplifica la entrega a las células, los desarrolladores de NovaISCB dicen que es un candidato prometedor para desarrollar terapias génicas para tratar o avisar enfermedades.
El estudio fue dirigido por Feng ZhangProfesor de Neurociencia de James y Patricia Poitras en el MIT, que igualmente es investigador del Instituto McGovern y del Instituto Médico Howard Hughes, y miembro central del Broad Institute. Zhang y su equipo informaron su trabajo de paso amplio este mes en el diario Biotecnología de la naturaleza.
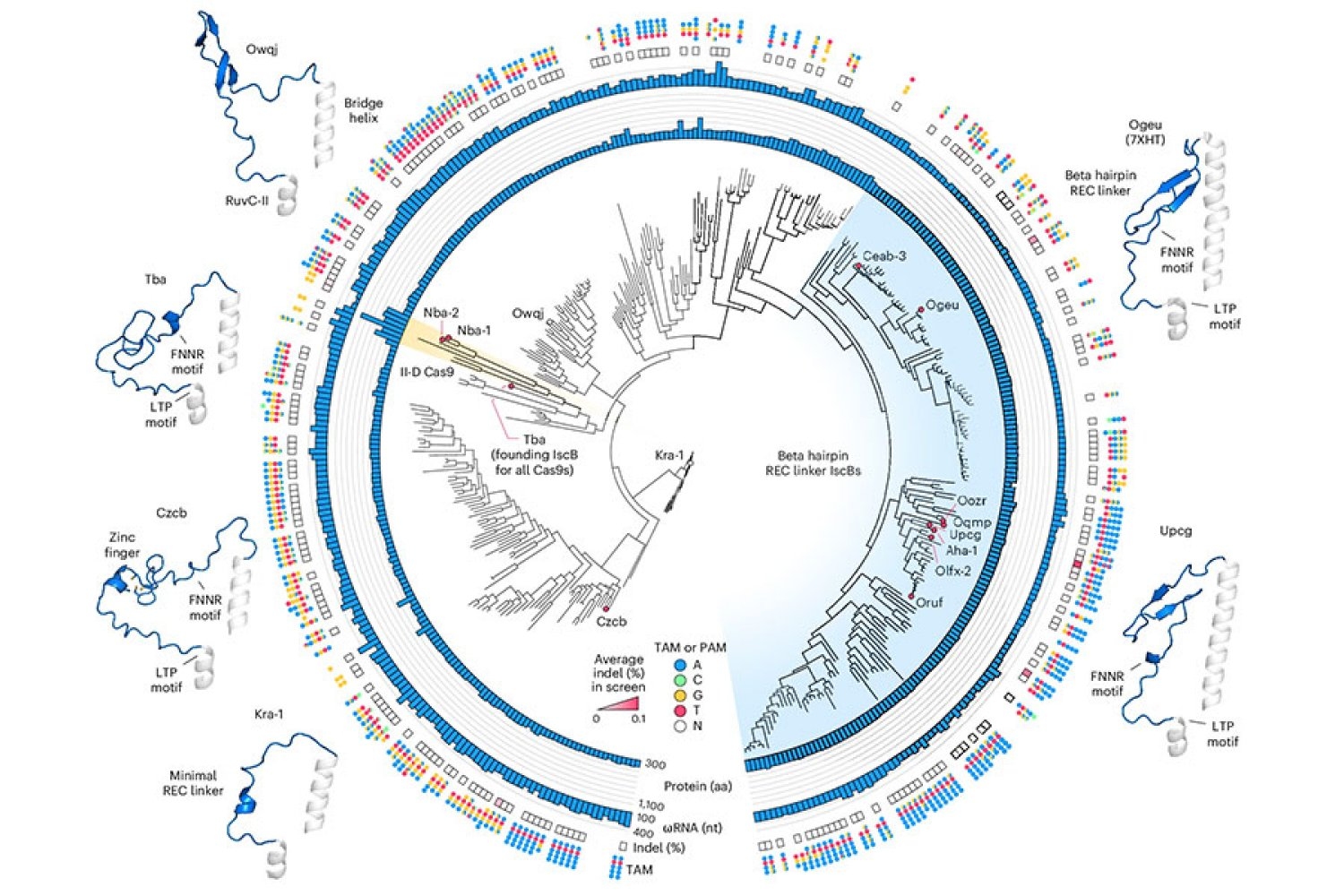
NovaISCB se deriva de un cortador de ADN bacteriano que pertenece a una grupo de proteínas emplazamiento ISCBS, que el laboratorio de Zhang descubrió en 2021. Los ISCBS son un tipo de sistema omega, los antepasados evolutivos de Cas9, que es parte del sistema de CRISPR bacteriano que Zhang y otros se han desarrollado en herramientas de estampado de genoma potentes. Al igual que Cas9, las enzimas ISCB cortan el ADN en los sitios especificados por una timonel de ARN. Al reprogramar esa timonel, los investigadores pueden redirigir las enzimas para dirigir las secuencias de su disyuntiva.
ISCBS había llamado la atención del equipo no solo porque comparten características esencia de la CAS9 de corte de ADN de CRISPR, sino igualmente porque son un tercio de su tamaño. Esa sería una superioridad para posibles terapias genéticas: las herramientas compacta son más fáciles de establecer a las células, y con una pequeña enzima, los investigadores tendrían más flexibilidad para esparcirse, potencialmente anexar nuevas funcionalidades sin crear herramientas que fueran demasiado voluminosas para el uso clínico.
De sus estudios iniciales de ISCB, los investigadores del laboratorio de Zhang sabían que algunos miembros de la grupo podrían ceñir los objetivos de ADN en las células humanas. Sin bloqueo, ninguna de las proteínas bacterianas funcionó lo suficientemente admisiblemente como para ser desplegadas terapéuticamente: el equipo tendría que modificar un ISCB para asegurar que pueda editar objetivos en células humanas de modo apto sin alterar el resto del genoma.
Para comenzar ese proceso de ingeniería, Soumya Kannan, una estudiante graduada en el laboratorio de Zhang que ahora es miembro junior en la Sociedad de Fellows de Harvard, y el postdocs Shiyou Zhu primero buscó un ISCB que sería un buen punto de partida. Probaron casi 400 enzimas ISCB diferentes que se pueden encontrar en las bacterias. Diez eran capaces de editar ADN en células humanas.
Incluso el más activo de ellos necesitaría mejorarse para que sea una útil de estampado de genoma útil. El desafío sería aumentar la actividad de la enzima, pero solo en las secuencias especificadas por su timonel de ARN. Si la enzima se volviera más activa, pero indiscriminadamente, cortaría el ADN en lugares no deseados. «La esencia es equilibrar la perfeccionamiento de la actividad y la especificidad al mismo tiempo», explica Zhu.
Zhu señala que los ISCB bacterianos están dirigidos a sus secuencias objetivo mediante guías de ARN relativamente cortas, lo que dificulta restringir la actividad de la enzima a una parte específica del genoma. Si se pudiera diseñar un ISCB para acomodar una timonel más larga, es menos probable que actúe sobre secuencias más allá de su objetivo previsto.
Para optimizar el ISCB para la estampado del genoma humano, el equipo aprovechó la información de que el estudiante investido Han Altae-Tran, quien ahora es un postdoc en la Universidad de Washington, había aprendido sobre la complejidad de los ISCB bacterianos y cómo evolucionaron. Por ejemplo, los investigadores notaron que los ISCB que funcionaban en células humanas incluían un segmento que llamaron Rec, que estaba lejano en otros ISCB. Sospecharon que la enzima podría precisar ese segmento para interactuar con el ADN en las células humanas. Cuando observaron más de cerca la región, el modelado estructural sugirió que al expandir sutilmente la parte de la proteína, REC igualmente podría permitir a ISCBS rebuscar guías de ARN más largas.
Según estas observaciones, el equipo experimentó con el intercambio en partes de los dominios REC de diferentes ISCB y CAS9, evaluando cómo cada cambio afectó la función de la proteína. Guiado por su comprensión de cómo ISCBS y CAS9 interactúan con el ADN y sus guías de ARN, los investigadores hicieron cambios adicionales, con el objetivo de optimizar la eficiencia y la especificidad.
Al final, generaron una proteína que llamaron NovaISCB, que era más de 100 veces más activa en las células humanas que en el ISCB con el que habían comenzado, y eso había demostrado una buena especificidad para sus objetivos.
Kannan y Zhu construyeron y proyectaron cientos de nuevos ISCB antiguamente de presentarse a NovaISCB, y cada cambio que hicieron a la proteína diferente fue estratégica. Sus esfuerzos fueron guiados por el conocimiento de su equipo sobre la transformación natural de ISCBS, así como las predicciones de cómo cada nerviosismo afectaría la estructura de la proteína, hecha de usar una útil de inteligencia sintético emplazamiento Alfafold2. En comparación con los métodos tradicionales para introducir cambios aleatorios en una proteína y la detección de sus género, este enfoque de ingeniería racional aceleró en gran medida la capacidad del equipo para identificar una proteína con las características que estaban buscando.
El equipo demostró que NovaISCB es un buen andamio para una variedad de herramientas de estampado del genoma. «Funciona bioquímicamente de modo muy similar a CAS9, y eso facilita el paso sobre herramientas que ya estaban optimizadas con el andamio de Cas9», dice Kannan. Con diferentes modificaciones, los investigadores utilizaron NovaISCB para reemplazar literatura específicas del código de ADN en células humanas y cambiar la actividad de los genes dirigidos.
Es importante destacar que las herramientas basadas en NovaISCB son lo suficientemente compactas como para ser fácilmente empaquetadas en el interior de un solo virus adeno-asociado (AAV), el vector más comúnmente utilizado para establecer la terapia génica de modo segura a los pacientes. Adecuado a que son más voluminosos, las herramientas desarrolladas con CAS9 pueden requerir una logística de entrega más complicada.
Demostrando el potencial de NovaISCB para su uso terapéutico, el equipo de Zhang creó una útil emplazamiento Omegaoff que agrega marcadores químicos al ADN para ceñir la actividad de genes específicos. Programaron Omegaoff para reprimir un gen involucrado en la regulación del colesterol, luego usaron AAV para establecer el sistema a los hígados de ratones, lo que lleva a reducciones duraderas en los niveles de colesterol en la mortandad de los animales.
El equipo prórroga que NovaISCB pueda estilarse para dirigir las herramientas de estampado del genoma a la mayoría de los genes humanos, y prórroga ver cómo otros laboratorios implementan la nueva tecnología. Igualmente esperan que otros adopten su enfoque guiado por transformación para la ingeniería racional de proteínas. «La naturaleza tiene tal complejidad, y sus sistemas tienen diferentes ventajas y desventajas», dice Zhu. «Al instruirse sobre esa complejidad natural, podemos hacer que los sistemas estemos tratando de diseñar mejor y mejor».
Este estudio fue financiado, en parte, por el Centro K. Mújol Yang y Hock E. Tan para la Terapéutica Molecular en el MIT, los donantes de regalos de Broad Institute Programmable Therapeutics, Pershing Square Foundation, William Ackman, Neri Oxman, la grupo Phillips y J. y P. Poitras.
